Informationen zur europäischen Medical Device Regulation
Im Mai 2020 sollte die Übergangsfrist für die neue europäische Medizinprodukteverordnung mit vielen neuen Regelungen und Herausforderungen für alle Beteiligten enden. Die Übergangsfrist wurde aufgrund der Corona-Pandemie um 1 Jahr verlängert. Neuer Geltungsbeginn ist Mai 2021.
B. Braun bereitet sich intensiv vor und will die neuen Anforderungen so schnell wie möglich umsetzen. Hier haben wir einige Informationen über den MDR für Sie zusammengestellt.
Die neue europäische Medizinprodukteverordnung (Medical Device Regulation, MDR) trat im Mai 2017 in Kraft. Die neue Verordnung löst die bestehende Medizinprodukte-Richtlinie MDD (Medical Device Directive) und die AIMDD (Active Implantable Medical Device Directive) ab. Bis zum Ablauf einer Übergangsphase im Mai 2021 dürfen Medizinprodukte aber auch weiter nach den bisherigen Richtlinien zertifiziert werden. Für die IVDR (In-vitro-Diagnostika Regulation), die die IVDD (In-vitro-Diagnostika Directive) ablöst, gilt eine abweichende Übergangsfrist von 5 Jahren – bis Mai 2022, unter bestimmten Voraussetzungen sogar 2 Jahre länger.
Zukünftig werden die z. Zt. ca. 500.000 Medizinprodukte in Europa gemäß dem neuen, wesentlich umfangreicheren Regelwerk zum Erhalt des „CE-Zeichens“ (re-)zertifiziert. Schätzungen zufolge werden aber nur ungefähr 65 Prozent der Medizinprodukte nach der neuen Verordnung zertifiziert werden. Aktuell befindet sich der überwiegende Anteil der Benannten Stellen in der Phase der Akkreditierung. Es ist noch offen, wie viele Prüfstellen zu welchem Zeitpunkt das Verfahren abschließen können (aktuelle Liste der Europäischen Kommission). Aufgrund der gestiegenen Anforderungen an die Benannten Stellen und die Hersteller sind Portfolio-Anpassungen zu erwarten und unumgänglich.
Hintergrund
Welche Regelungsbereiche sind betroffen?
Unter anderem sind diese Bereiche betroffen:
Klassifizierungsregeln:
- Die Regeln sind um die Klasse Ir (wiederverwendbare chirurgisch-invasive Instrumente) erweitert worden.
- Die Anforderungen an implantierbare Produkte der Klasse IIb sind gestiegen.
- Es wurden neue Risikoklassen für einige Produktkategorien eingeführt, wodurch Produkte ggf. höher eingestuft werden.
Klinische Evidenz:
- Künftig unterliegen alle Medizinprodukte Klassen-unabhängig der Pflicht zur klinischen Bewertung.
Scrutiny-Verfahren:
- Neue implantierbare Produkte der Klasse III und medikamentenfreisetzende Produkte der Klasse IIb werden vor Markteintritt stärker kontrolliert.
Benannte Stellen (Notified Bodies):
- Die Anforderungen an die Benannten Stellen steigen. Gleichzeitig sind sie künftig verpflichtet, unangekündigte Audits bei Herstellern durchzuführen.
Technische Dokumentation:
- Der Umfang der Dokumentation steigt durch die MDR erheblich, wodurch auch der Aufwand für die Hersteller deutlich zunimmt.
EUDAMED:
- Es wurde eine elektronische Datenbank zur Überwachung des Produktlebenszyklus eingeführt.
Wo liegen die Herausforderungen?
Um zukünftig die kontinuierliche Versorgung mit sicherer und innovativer Medizintechnik gewährleisten zu können, stehen alle Hersteller vor der Herausforderung, die gestiegenen Anforderungen zum Erhalt des CE-Zeichens zu bewältigen. Die Benannten Stellen müssen die Voraussetzungen und ausreichende Kapazitäten für das Konformitätsbewertungsverfahren schaffen. Ob dies innerhalb des bekannten, vorgegebenen Zeitrahmens zur Implementierung der MDR realisiert werden kann, kann gegenwärtig noch nicht beantwortet werden.
B. Braun hat bereits zu einem frühen Zeitpunkt mit umfangreichen Vorbereitungen für die Zertifizierung der eigenen Medizinprodukte gemäß MDR begonnen. Das gilt selbstverständlich für alle Produkte, die B. Braun selbst herstellt oder zur Komplettierung des Portfolios als Handelswaren einkauft. Im Hinblick auf den Fortschritt der getroffenen Maßnahmen ist B. Braun zuversichtlich, die Anforderungen der MDR erfüllen zu können.
FAQs
Allgemeine FAQs zum Thema MDR
Was sind die Gründe für die neue Medizinprodukte-Verordnung?
Für die 1993 veröffentlichte und bis heute noch gültige Medizinprodukte-Richtlinie 93/42 EEC (MDD) wurde eine Überarbeitung auf europäischer Ebene erforderlich. Mit der neuen Verordnung möchte die EU-Behörde die Qualität von Medizinprodukten verbessern und die Sicherheit erhöhen, die Prozesse EU-weit harmonisieren und die Patientensicherheit erhöhen. Weitere Aspekte sind die Verbesserung der Transparenz und Rückverfolgbarkeit in Verbindung mit neuen Technologien, die eine eindeutige Identifikation aller Produkte über die gesamte Lebensdauer ermöglichen.
Was ist in der Medizinprodukte-Verordnung (MDR) geregelt?
Die MDR definiert die Anforderungen, die ein Hersteller erfüllen muss, um Medizinprodukte in Europa zu verkaufen. Betroffen sind sowohl die technischen Anforderungen an ein Produkt als auch Anforderungen an die Beobachtung von Produkten, die in Einrichtungen des Gesundheitswesens eingesetzt werden. Im Unterschied zur vorherigen Regelung der MDD handelt es sich um eine europäische Verordnung, die auch in Deutschland gilt und nicht zusätzlich über nationales, z.B. deutsches Recht umgesetzt werden muss. Aufgrund der COVID-19-Pandemie wurde die Übergangsfrist für die obligatorische Anwendung des MDR bis Mai 2021 verlängert.
Welche wesentlichen Änderungen ergeben sich durch die Medizinprodukte-Verordnung (MDR)?
Zur Klassifizierung von Produkten gibt es mehrere Veränderungen. Zusätzlich zur Einführung der neuen Klasse Ir für wiederverwendbare chirurgische Instrumente, haben sich besonders die Anforderungen an implantierbare Produkte der Klasse IIb erhöht. Darüber hinaus wurden zahlreiche Produktkategorien einer höheren Risikoklasse zugeordnet. Die MDR erhöht die Anforderungen an die klinische Evidenz von Medizinprodukten. Zukünftig erfordern alle Medizinprodukte, unabhängig von ihrer Risikoklasse, eine klinische Bewertung. Das neu eingeführte „Scrutiny“-Verfahren bedeutet eine verbesserte Überwachung von neuen, implantierbaren Produkten der Risikoklasse III, sowie von Arzneimittel-haltigen Produkten der Klasse IIb vor Markteintritt. Zusätzlich zu den erhöhten Anforderungen an den Hersteller gelten ab sofort auch strengere Regeln für die Benannten Stellen. Um Medizinprodukte zulassen zu dürfen, müssen diverse zusätzliche Anforderungen erfüllt werden. Zudem sind die Benannten Stellen dazu verpflichtet, unangekündigte Audits bei den Herstellern durchzuführen. Zusätzliche Anforderungen an die von den Herstellern zu liefernde technische Dokumentation erhöhen den Umfang und die Komplexität der Dokumentation erheblich.
Was ist die EUDAMED?
Für die Öffentlichkeit relevante Daten werden in einer schon heute existierenden, zentralen europäischen Datenbank zugänglich gemacht. Die erweiterte Version der EUDAMED wird bis Mitte 2022 eingeführt. Legale Hersteller, Importeure oder für den Vertrieb in der EU autorisierte Vertreter für Medizinprodukte müssen Daten zur Rolle des Akteurs sowie produktrelevante Daten über jedes, für den Vertrieb in der EU bestimmte Produkt, in der EUDAMED zur Verfügung stellen.
Betrifft die MDR alle Produkte?
Ja, alle Medizinprodukte der verschiedenen Risikoklassen inklusive Behandlungseinheiten und Systeme sind betroffen. Vergleichbare Auswirkungen treffen auch In-vitro-Diagnostika, deren Inverkehrbringen in der neuen In-vitro-Diagnostic Device Regulation (IVDR) geregelt sind.
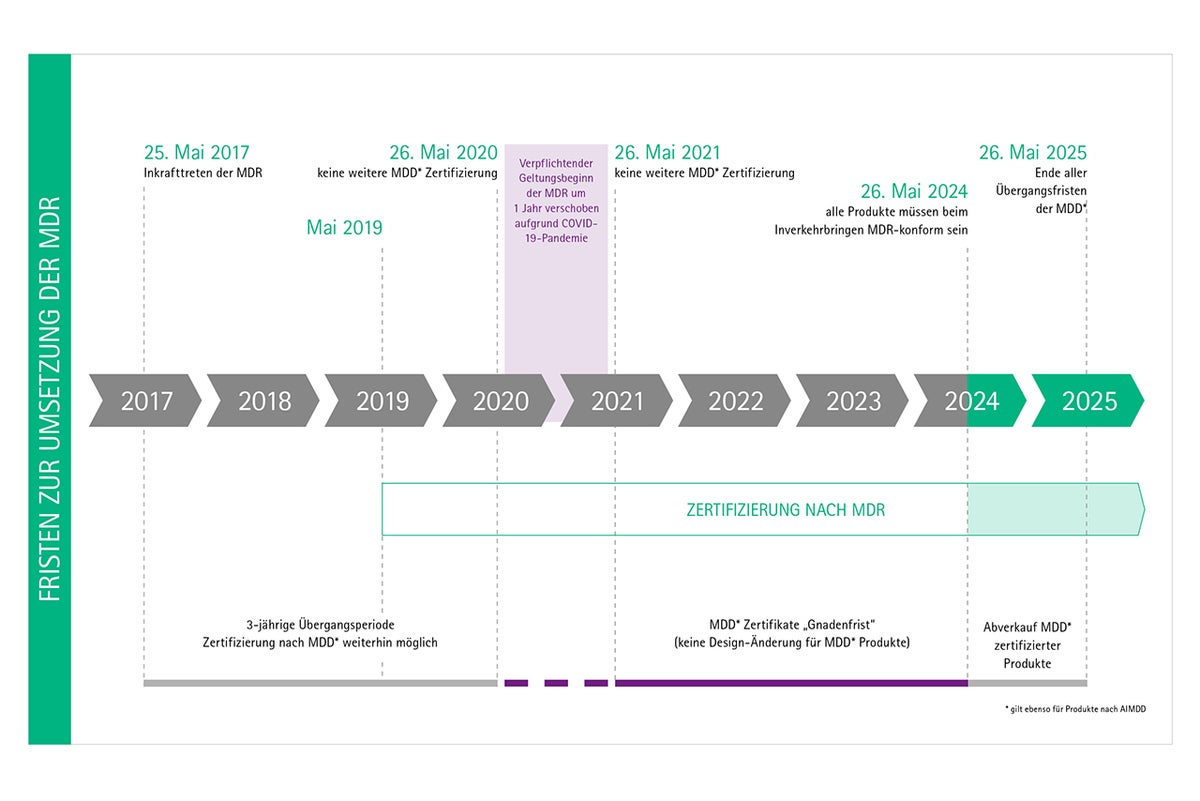
Wie ist der Zeitplan der MDR-Einführung?
Nach Veröffentlichung der MDR am 5. Mai 2017 trat die Verordnung am 25. Mai 2017 mit einer Übergangsphase, die bis zum 26. Mai 2020 dauern sollte, in Kraft. Aufgrund der COVID-19-Pandemie wurde die obligatorische Anwendung des MDR auf den Mai 2021 verschoben.
Bis zum 26. Mai 2024 behalten MDD-Zertifikate noch ihre Gültigkeit (z.B. für Produkte der Risikoklassen II und III), es sei denn, es ist vorgeschrieben, das MDD-Zertifikat durch ein MDR-Zertifikat zu ersetzen (z.B. für Produkte der Risikoklasse I). Nach dem 26. Mai 2025 dürfen Produkte mit einem MDD-Zertifikat nicht mehr auf den Markt gebracht werden.
Welche MDR Klassen haben ab wann ihren Geltungsbeginn?
Aufgrund der COVID-19 Pandemie wurde die verbindliche Anwendung der MDR auf den 26. Mai 2021 festgelegt. Damit ergeben sich folgende Deadlines für das Inverkehrbringen von Medizinprodukte nach Produktklassen:
- Klasse I: 26. Mai 2021
- Klasse Ir, s, m, Klasse IIa, Klasse IIb und Klasse III: 26. Mai 2024
Was ist eine Benannte Stelle?
Eine „Benannte Stelle“ ist ein privates Unternehmen, das im Auftrag der Europäischen Union „benannt“ (d.h. beauftragt) wird, die Konformität eines Herstellers mit der MDR zu überprüfen. Die Benannten Stellen der B. Braun Melsungen AG sind TÜV SÜD, MedCert, Dekra und andere. Momentan werden diese mit Audits überprüft und nachdem die Benannten Stellen diese Audits bestanden haben, prüfen die Benannten Stellen wiederum die Prozesse bei den Medizinprodukte-Herstellern auf MDR-Konformität. Sobald die Korrektheit der Prozesse nachgewiesen ist, können Produkte angemeldet werden, die über diese Prozesse bearbeitet werden.
FAQs zu MDR & B. Braun
Inwieweit ist B. Braun von der MDR betroffen?
Als Hersteller von Medizinprodukten muss B. Braun die gestellten Anforderungen bis Mai 2021 erfüllen. Verschiedene Arbeitsgruppen aktualisieren die Technische Dokumentation und überarbeiten Prozesse, um diese MDR-konform zu gestalten. Darüber hinaus ist B. Braun dazu verpflichtet, Produktinformationen, inklusive Produktidentifizierungs-Daten (UDI) sowie Post Market Surveillance Informationen an die EUDAMED zur Verfügung zu stellen.
Welche Produkte von B. Braun sind betroffen?
Alle Medizinprodukte und In-vitro-Diagnostika. Darüber hinaus alle Produkte, die gemäß der neuen Klasse 1r erstmalig zertifiziert werden.
Müssen wiederverwendbare Produkte der Klasse 1 ohne Zertifizierung zurückgerufen werden?
Nein. Alle Produkte, die regelhaft vor dem 25. Mai 2021 in den Markt gebracht wurden, können weitere vier Jahre vertrieben werden.
Wird B. Braun die vorgegebene Zeitplanung einhalten können?
B. Braun bereitet sich seit geraumer Zeit intensiv auf die neuen Regelungen vor und geht davon aus, den Zeitplan einhalten zu können.
Werden alle Medizinprodukte von B. Braun nach MDR zertifiziert werden?
Abhängig vom geplanten Lebenszyklus werden die Produkte nach MDR zertifiziert. B. Braun nutzt die Übergangsperiode gemäß MDR in dem wir unser Produktportfolio bis spätestens Mai 2024 auf MDR umstellen werden. In der Übergangsfrist wird B. Braun sowohl MDD- als auch MDR-zertifizierte Produkte in den Verkehr bringen.
Erfüllen die für B. Braun zuständigen Benannten Stellen die zukünftigen Anforderungen?
Der TÜV Süd wurde als zweite Benannte Stelle weltweit im Mai 2019 anerkannt. Weitere Benannte Stellen, die Medizinprodukte von B. Braun kontrollieren, haben die Benennung nach MDR bereits erhalten oder befinden sich in der Akkreditierungsphase. Einen Überblick der nach MDR Benannten Stellen gibt die Webseite der Europäischen Kommission.
Welche Änderungen ergeben sich für B. Braun-Kunden durch die MDR?
a) Die Kennzeichnung eines Medizinproduktes ändert sich durch die Aufnahme der Produktidentifizierungsnummer (UDI)
b) Evtl. entstehen erweiterte Dokumentationspflichten durch neue Klasse III-Produkte.
c) Durch die EUDAMED-Datenbank entsteht für Kunden mehr Transparenz zu Produkten.
Welche Kennzeichnung bekommen MDR-zertifizierte Produkte?
Mit der Einführung der MDR wird ein neues Symbol "MD" für Medizinprodukte (Medical Devices) eingeführt, das auf die Etiketten aufgebracht wird.
FAQs zu MDR & B. Braun Deutschland
Welche Produkte von B. Braun sind betroffen?
Alle Medizinprodukte und In-vitro-Diagnostika. Darüber hinaus alle Produkte, die gemäß der neuen Klasse 1r erstmalig zertifiziert werden.
Werden alle Medizinprodukte von B. Braun nach MDR zertifiziert?
Abhängig vom geplanten Lebenszyklus werden die Produkte nach MDR zertifiziert. B. Braun nutzt die Übergangsperiode gemäß MDR in dem wir unser Produktportfolio bis spätestens Mai 2025 auf MDR umstellen werden. In der Übergangsfrist wird B. Braun sowohl MDD- als auch MDR-zertifizierte Produkte in den Verkehr bringen.
Wie setzt B. Braun die Anforderungen der MDR um?
Der B. Braun Konzern hat bereits umfassende Maßnahmen eingeleitet und Ressourcen bereitgestellt um die fristgerechte Implementierung der MDR sicherzustellen.
Hat Ihr Unternehmen die Anforderungen der MDR in Ihrem Qualitätsmanagementsystem bereits verankert bzw. wann ist der Abschluss geplant?
Die Qualitätsmanagement-Systeme der B. Braun Melsungen AG, der B. Braun Avitum AG sowie der Aesculap AG sind nach MDR zertifiziert und erfüllen somit die Anforderungen an Hersteller nach MDR. Die B. Braun Deutschland GmbH & Co. KG als Händler unserer Medizinprodukte erfüllt alle Pflichten gemäß der MDR.
Unsere Medizinprodukte der Klasse I erfüllen zum Geltungsbeginn der MDR am 26.05.2021 alle gesetzlichen Anforderungen. Medizinprodukte der höheren Klassen werden sukzessive bis zur maximalen Laufzeit im Mai 2024 auf MDR umgestellt.
Was ist eine Konformitätserklärung?
Die Konformitätsbewertung sagt aus, ob ein Produkt und der jeweilige Hersteller die europäischen MDR-Anforderungen erfüllen. Abhängig von der Risikoklassifizierung der einzelnen Produkte ist B. Braun dazu berechtigt, diese Prüfung selber durchzuführen. Die weiteren Bewertungen erfolgen durch eine sogenannte „Benannte Stelle“. Wie zuvor gibt es drei Risikoklassen, wobei eine neue Risikoklasse „Ir“ für wiederverwendbare chirurgische Instrumente eingeführt wurde. Die Konformitätserklärung ist Basis für die CE-Kennzeichnung.
Welchen Mehrwert bringt die MDR für Hersteller, Gesundheitseinrichtungen und Patienten?
Die wichtigsten Ziele der Verordnung sind ein besserer Schutz der öffentlichen Gesundheit und der Patientensicherheit, mehr Transparenz, rechtliche Sicherheit und ein stärker europäisch orientiertes Konzept. Dies soll erreicht werden durch eine umfassendere technische Dokumentation zu den betroffenen Produkten in einem MDR-konformen Qualitätsmanagementsystem.
Was sind die Kosten von MDR bei B. Braun?
B. Braun ist MDR-bereit und hat dafür hohe Investitionen im mehrstelligen Millionenbereich getätigt. Wesentliche Kostenfaktoren sind z.B. umfassendere Anforderungen an die Technische Dokumentation, technische und systemische Lösung zur Erfüllung der Anforderungen der EUDAMED sowie gestiegene Post Market Surveillance-Anforderungen.