Sie haben sich erfolgreich abgemeldet.
Not registered yet?
Medizinprodukteverordnung
Informationen zur Medizinprodukteverordnung
Die neue europäische Medizinprodukteverordnung (MDR) mit vielen neuen Vorschriften ist eine Herausforderung für alle Beteiligten. B. Braun bereitet sich intensiv vor und möchte die neuen Anforderungen so schnell wie möglich anwenden. Hier haben wir einige Informationen zur MDR für Sie zusammengestellt.
Die neue europäische Medizinprodukteverordnung (MDR) ist im Mai 2017 in Kraft getreten. Die neue Verordnung ersetzt die bestehende Medizinprodukterichtlinie (MDD) und die Richtlinie über aktive implantierbare Medizinprodukte (AIMDD ).
In Zukunft werden die derzeit ca. 500.000 Medizinprodukte in Europa nach der neuen, wesentlich umfassenderen Richtlinie für den Erhalt der CE-Kennzeichnung rezertifiziert. Nach aktuellen Schätzungen werden nur etwa 65 Prozent der Medizinprodukte nach der neuen Verordnung zertifiziert. Einige benannte Stellen befinden sich noch in der Akkreditierungsphase, und es ist nicht ganz klar, wie viele benannte Stellen den Prozess abschließen können (Liste auf der Website der Europäischen Kommission). Aufgrund der gestiegenen Anforderungen an die benannten Stellen und die Hersteller sind Portfolioanpassungen zu erwarten und unumgänglich.
Implementierungszeitraum der MDR bei B. Braun
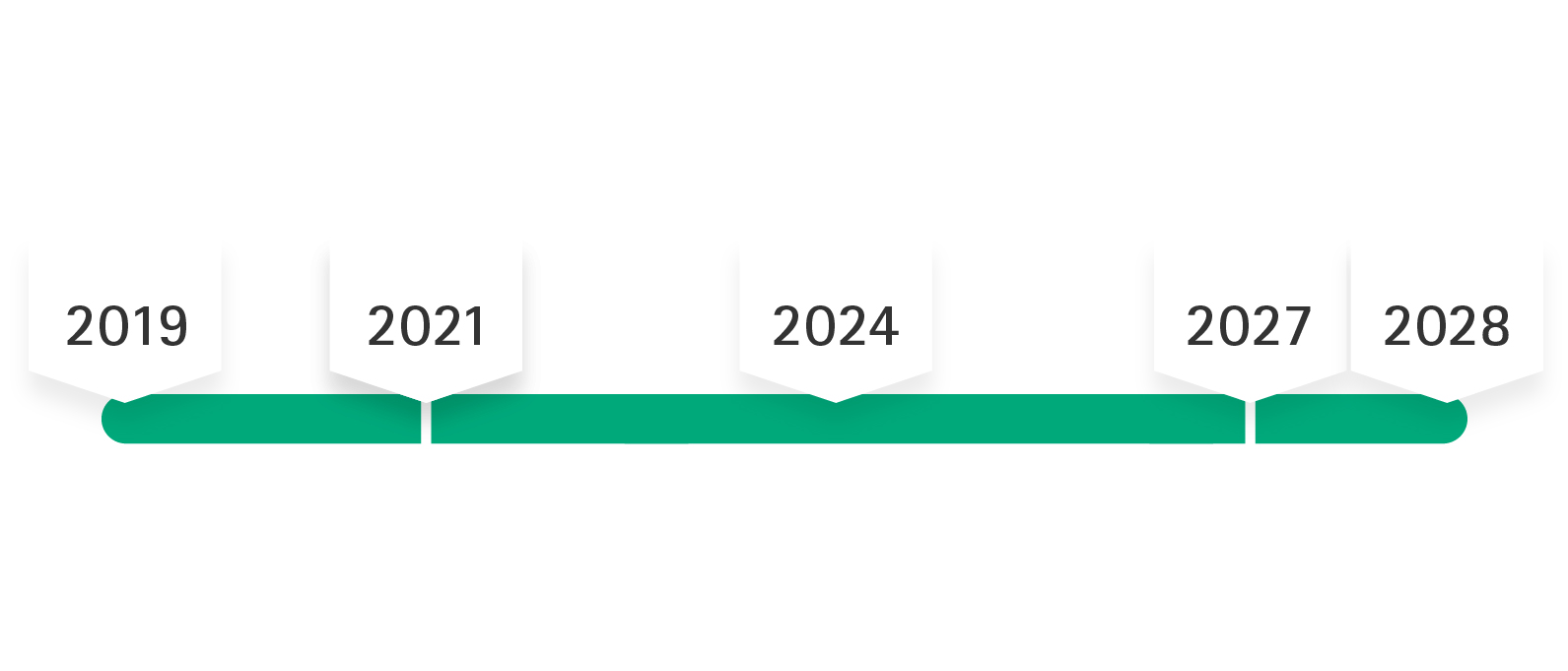
Mai 2021 - Mai 2027/2028
MDD-Zertifikat „Gnadenfrist“: Keine Designänderung für MDD-zertifizierte Produkte
/
Mai 26, 2024
Für die Produkte muss ein MDR-Antrag unterzeichnet sein (außer bei ausverkauften MDD-Produkten)
/
Bis 2027 / 2028
MDD-Zertifikate behalten ihre Gültigkeit (Zeitrahmen hängt von der Produktrisikoklasse ab)
/
Welche Regelungsbereiche sind betroffen?
Betroffen sind unter anderem diese Bereiche:
- Klassifizierungsregeln: Die Regeln wurden auf die Klasse Ir (wiederverwendbare chirurgisch invasive Instrumente) erweitert. Die Anforderungen an implantierbare Produkte der Klasse llb sind gestiegen. Für mehrere Produktkategorien wurden neue Risikoklassen eingeführt, was möglicherweise eine Aufwertung der Produkte zur Folge hat.
- Klinische Evidenz: In Zukunft unterliegen alle Medizinprodukte unabhängig von der Klasse einer klinischen Bewertungspflicht.
- Kontrollverfahren (Konsultationsverfahren): Neue implantierbare Produkte der Klasse III und aktive Produkte der Klasse llb, die Arzneimittel verabreichen und/oder entfernen, müssen vor dem Markteintritt strenger kontrolliert werden.
- Benannte Stellen: Die Anforderungen an die Benannten Stellen steigen. Gleichzeitig sind sie künftig verpflichtet, unangekündigte Audits bei Herstellern durchzuführen.
- Technische Dokumentation: Dokumentation aufgrund der MDR erhöht den Aufwand für Hersteller erheblich.
- EUDAMED: Eine elektronische Datenbank zur Überwachung des Produktlebenszyklus wurde eingeführt.
Welche Herausforderungen gibt es?
Um eine kontinuierliche Versorgung mit sicherer und innovativer Medizintechnik gewährleisten zu können, stehen alle Hersteller vor der herausfordernden Aufgabe, die gestiegenen Anforderungen an die CE-Kennzeichnung zu bewältigen. Die benannten Stellen legen den Grundstein und schaffen ausreichende Kapazitäten für das Konformitätsbewertungsverfahren.
Bereits zu einem früheren Zeitpunkt begann B. Braun mit umfassenden Vorbereitungen für die Zertifizierung der eigenen Medizinprodukte nach MDR. Dies gilt selbstverständlich für alle Produkte, die B. Braun selbst herstellt oder als Handelsware kauft, um sein Portfolio zu vervollständigen. B. Braun ist hinsichtlich des Fortschritts der getroffenen Maßnahmen zuversichtlich, die Anforderungen der MDR bis Mai 2024 erfüllen zu können.
Allgemeine FAQs zur MDR
Eine Revision der Medizinprodukterichtlinie 93/42 EWG (MDD), die 1993 veröffentlicht wurde und bis heute gilt, wurde auf europäischer Ebene notwendig. Mit der neuen Verordnung möchten die EU-Behörden die Qualität von Medizinprodukten verbessern und die Sicherheit erhöhen, die Prozesse in der EU harmonisieren und die Patientensicherheit erhöhen. Weitere Aspekte sind die Verbesserung der Transparenz und Rückverfolgbarkeit in Verbindung mit neuen Technologien, die eine eindeutige Identifizierung aller Produkte während ihres gesamten Lebenszyklus ermöglichen.
Die MDR definiert die Anforderungen, die ein Hersteller erfüllen muss, um Medizinprodukte in Europa verkaufen zu können. Betroffen sind sowohl die technischen Anforderungen an ein Produkt als auch die Anforderungen an die Überwachung von Produkten, die in Gesundheitseinrichtungen eingesetzt werden.
Im Zusammenhang mit der Klassifizierung von Produkten gibt es mehrere Änderungen. Neben der Einführung der neuen Klasse lr für wiederverwendbare chirurgische Instrumente wurden insbesondere die Anforderungen an implantierbare Produkte der Klasse IIb erhöht. Darüber hinaus wurden zahlreiche Produktkategorien einer höheren Risikoklasse zugeordnet. Die MDR erhöht die Anforderungen an die klinische Evidenz von Medizinprodukten. Künftig müssen alle Medizinprodukte unabhängig von ihrer Risikoklasse einer klinischen Bewertung unterzogen werden. Das neu eingeführte Kontrollverfahren bedeutet eine verbesserte Überwachung neuer implantierbarer Produkte der Risikoklasse III sowie aktiver Medizinprodukte, die Arzneimittel der Klasse IIb vor Markteinführung verabreichen und/oder entfernen. Zusätzlich zu den gestiegenen Anforderungen an die Hersteller gibt es nun strengere Vorschriften für benannte Stellen. Um Medizinprodukte freigeben zu können, müssen verschiedene zusätzliche Anforderungen erfüllt werden. Außerdem sind die benannten Stellen verpflichtet, unangekündigte Audits bei Herstellern durchzuführen. Zusätzliche Anforderungen an die technische Dokumentation, die von den Herstellern zur Verfügung gestellt werden müssen, erhöhen den Umfang und die Komplexität der Dokumentation erheblich.
Es gibt keine genaue Kennung auf dem Produkt, die auf die MDR-Konformität hinweist. Dennoch wird mit Einführung der MDR ein neues ISO-Symbol „MD“ für Medizinprodukte auf dem Etikett angebracht.
Ja, alle Medizinprodukte aller Risikoklassen einschließlich der Behandlungseinheiten und -systeme sind betroffen.
Daten, die für die Öffentlichkeit relevant sind, werden in einer zentralen europäischen Datenbank zugänglich gemacht, die bereits heute existiert. Die erweiterte Version von EUDAMED wird schrittweise eingeführt, d. h. freiwillige Nutzung einer „Minimal Viable Product“ (MVP) Version im Jahr 2022. Die obligatorische Nutzung der EUDAMED wird voraussichtlich im zweiten Quartal 2025 erfolgen. Siehe EUDAMED-Zeitleiste
Gesetzliche Hersteller, Hersteller von System- und Verfahrenspackungen, Importeure oder bevollmächtigte Vertreter für den Vertrieb von Medizinprodukten in der EU müssen die EUDAMED-Daten zur Rolle des Akteurs sowie die produktrelevanten Daten für jedes einzelne Produkt, das in der EU vertrieben werden soll, ergänzen.
Nach der Veröffentlichung der MDR am 5. Mai 2017 trat die Verordnung am 25. Mai 2017 in Kraft, mit einer Übergangsfrist, die bis zum 26. Mai 2020 dauern sollte. Aufgrund der COVID-19-Pandemie wurde die verpflichtende Anwendung der MDR auf Mai 2021 verschoben. Gemäß 2. MDR-Änderung verlängert sich die Übergangszeit bis max. Dezember 2028, d.h. MDD-Zertifikate behalten ihre Gültigkeit (d. h. nur bis max. Dezember 2027 für Produkte der Risikoklassen IIb implantierbar und III), wenn bestimmte Voraussetzungen erfüllt sind.
Medizinprodukte dürfen kein inakzeptables Risiko für Gesundheit und Sicherheit darstellen.
Das QMS muss bereits MDR-konform sein.
Der MDR-Antrag wird bis Mai 2024 unterzeichnet.
Der MDR-Vertrag mit der benannten Stelle wird bis September 2024 unterzeichnet.
keine wesentlichen Änderungen, die auf MDD-Produkte anzuwenden sind.
Gemäß der 2. MDR-Änderung besteht keine Endabverkaufsfrist mehr. Der bisher geplante Abverkaufszeitraum (d.h. kein weiterer Vertrieb von MDD-zertifizierten Produkten nach Mai 2025) wurde storniert.
MDD-EG-Zertifikat Gültigkeit automatisch verlängert (keine neuen Zertifikate auszustellen).
MDD- und MDR-EC-Zertifikate werden parallel über den Zeitraum der Fristverlängerung gültig sein.
Sowohl MDD- als auch MDR-Produkte können parallel in Verkehr gebracht werden.
Aufgrund der COVID-19-Pandemie wurde die MDR für den 26. Mai 2021 verpflichtend beantragt. Daraus ergeben sich folgende Fristen für die Vermarktung von Medizinprodukten nach Produktklassen:
Klasse I: 26. Mai 2021
Klasse Ir, s, m, Klasse IIa, Klasse IIb und Klasse III: 26. Mai 2024
Die Konformitätsbewertung sagt aus, ob ein Produkt und der jeweilige Hersteller den europäischen MDR-Anforderungen entsprechen. Je nach Risikoeinstufung der einzelnen Produkte ist B. Braun berechtigt, dieses Audit selbst durchzuführen. Die zusätzlichen Bewertungen werden über eine sogenannte „notifizierte Stelle“ durchgeführt.
Benannte Stelle ist ein privates Unternehmen, das im Namen der Europäischen Union benannt wird, um die Konformität eines Herstellers mit der MDR zu bewerten. Derzeit werden sie im Rahmen von Audits bewertet, und nachdem sie die Audits bestanden haben, bewerten die benannten Stellen dann die Prozesse der Medizinproduktehersteller auf MDR-Konformität. Sobald die Konformität der Prozesse überprüft wurde, können Produkte, die verarbeitet werden, über diese Prozesse registriert werden.
Auch nach der Umstellung des gesamten Produktportfolios auf MDR entstehen den Herstellern durch die gestiegenen Anforderungen der MDR erhebliche Mehrkosten.
Die Hauptziele der Verordnung sind ein besserer Schutz der öffentlichen Gesundheit und der Patientensicherheit, mehr Transparenz, Rechtssicherheit und ein stärker auf Europa ausgerichtetes Konzept. Dies soll durch eine umfangreichere technische Dokumentation der betroffenen Produkte in einem MDR-konformen Qualitätsmanagementsystem erreicht werden.
Die Verordnung (EU) 2023/607 sieht vor, dass Zertifikate, die bis zum 25. Mai 2017 gemäß der MDD ausgestellt wurden und am 26. Mai 2021 noch gültig sind, unabhängig von ihrem Ablaufdatum gültig bleiben. Das bedeutet, dass Produkte, für die eine MDD-Konformitätserklärung bis zum 26. Mai 2021 gültig war, weiterhin auf dem EU-Markt in Verkehr gebracht werden dürfen.
Produkte, die bereits vor dem 26. Mai 2021 auf dem Markt waren und für die eine MDD-Konformitätserklärung vorlag, können weiterhin auf den Markt gebracht werden, solange die MDD-Konformitätserklärung gültig ist. Die verlängerte Gültigkeit gilt bis Mai 2027 (für die Risikoklassen III und IIb implantierbar) und bis Mai 2028 (für alle anderen Risikoklassen - außer Klasse I).
Mit der Verordnung (EU) 2023/607 wurde die Verkaufsfrist für MDD-Produkte abgeschafft, die ursprünglich am 27. Mai 2025 auslaufen sollte.
Der Hersteller bestätigt mit der Eigenerklärung des Herstellers (Bestätigungsschreiben), dass sein Medizinprodukt den geltenden gesetzlichen Anforderungen entspricht. Gemäß der Verordnung (EU) 2023/607 wurde die Gültigkeit aller Zertifikate, die am 20. März 2023 noch nicht abgelaufen waren, bis zum 31. Dezember 2027 (für Produkte der Klassen III und IIb implantierbar) oder bis zum 31. Dezember 2028 (für alle anderen Produkte - außer Klasse I) verlängert. Der Hersteller muss die folgenden Bedingungen für die weitere Gültigkeit der Zertifikate und Konformitätserklärungen erfüllen.
- Einrichtung eines Qualitätsmanagementsystems (QMS) in Übereinstimmung mit der MDR bis zum 26. Mai 2024.
- Beantragung einer Konformitätsbewertung bei der benannten Stelle bis zum 26. Mai 2024.
- Unterzeichnung einer schriftlichen Vereinbarung zur Konformitätsbewertung durch die benannte Stelle bis zum 26. September 2024.
- Keine wesentlichen Produktveränderungen und kein inakzeptables Risiko des Produkts für Gesundheit und Sicherheit.
FAQs zu MDR & B. Braun
Als Hersteller von Medizinprodukten muss B. Braun die Anforderungen der MDR erfüllen. Verschiedene Arbeitsgruppen aktualisieren die technische Dokumentation und überarbeiten Prozesse, um sicherzustellen, dass sie MDR-konform sind. Darüber hinaus ist B. Braun verpflichtet, Produktinformationen, einschließlich eindeutiger Geräteidentifikationsdaten (UDI), sowie Informationen zur Überwachung nach dem Inverkehrbringen an EUDAMED zu übermitteln.
Der B. Braun Konzern hat umfassende Maßnahmen eingeleitet und Ressourcen bereitgestellt, um die termingerechte Umsetzung der MDR sicherzustellen.
Alle Medizinprodukte.
B. Braun bereitet sich seit einiger Zeit intensiv auf die neuen Regelungen vor und geht davon aus, dass die Zeitschiene eingehalten werden kann.
Die Qualitätsmanagementsysteme der B. Braun Melsungen AG, B. Braun Avitum AG und Aesculap AG sind bereits nach der MDR zertifiziert und MDR-konforme technische Dokumentationen für unsere Produkte erstellt. Die Produktübergabe an MDR erfolgt sukzessive bis zur maximalen Laufzeit.
Generell ja – je nach geplantem Lebenszyklus sind die Produkte nach MDR zertifiziert. Wie in den Vorjahren wird B. Braun sein Produktportfolio weiter anpassen. Neue Produkte werden in das Portfolio aufgenommen und ältere Generationen ersetzt oder unwirtschaftliche oder veraltete Produkte aus dem Produktportfolio genommen. Im Rahmen unseres regulären Sortimentsmanagements werden wir entsprechende Sortimentsänderungen weiterhin zeitnah, offen, transparent und zielgerichtet an die jeweiligen betroffenen Kunden kommunizieren und, wo möglich, Alternativen anbieten.
B. Braun nutzt die MDR-Übergangsfrist, in der wir unser Produktportfolio auf MDR übertragen werden. In dieser Übergangszeit wird B. Braun sowohl MDD- als auch MDR-zertifizierte Produkte auf den Markt bringen.
Der TÜV Süd wurde im Mai 2019 als zweite notifizierte Stelle weltweit anerkannt. Weitere Benannte Stellen, die Medizinprodukte von B. Braun betreuen, sind MedCert, Dekra und TÜV Rheinland, die ihre Bezeichnung auch unter der MDR erhalten haben. Bitte klicken Sie auf den Link zur Website der Europäischen Kommission, um einen Überblick über MDR-akkreditierte benannte Stellen zu erhalten.
Website der Europäischen Kommission
a) Die Identifikation eines Medizinprodukts ändert sich durch die Aufnahme der Unique Device Identification (UDI).
b) Es besteht die Möglichkeit, dass sich durch neue Klasse III Produkte erweiterte Dokumentationspflichten ergeben.
c) Die EUDAMED-Datenbank bietet den Kunden mehr Transparenz in Bezug auf Produkte.
B. Braun ist MDR-ready und hat dafür bereits hohe Investitionen im mehrstelligen Millionenbereich getätigt. Wesentliche Kostenfaktoren sind umfassendere Anforderungen an die technische Dokumentation, technische und systemische Lösungen zur Erfüllung des erforderlichen EUDAMED-Datenmanagements sowie verstärkte Bemühungen zur Überwachung nach dem Inverkehrbringen.
B. Braun unterstützt Kunden aktiv bei der Informationsbeschaffung. Dazu werden seit Mai 2021 sukzessive Konformitätserklärungen und Gebrauchsinformationen digital zur Verfügung gestellt.
Konformitätserklärungen finden Sie online unter www.bbraun.com – einfach durch Eingabe des Produktnamens in das Suchfeld und Auffinden der entsprechenden Konformitätserklärung unter der Überschrift -bezogene Dokumente-. Die meisten Konformitätserklärungen der B. Braun Melsungen AG und der B. Braun Avitum AG sind über diesen Kanal abrufbar. Aus technischen Gründen kann B. Braun die Konformitätserklärungen für Produkte der Aesculap AG (mit Ausnahme des Nahtmaterialportfolios) mittelfristig nur online zur Verfügung stellen. Zur stichprobenartigen Abgabe von Konformitätserklärungen, die nicht online gefunden werden können, können die bekannten Ansprechpartner aus dem Kundendienst der B. Braun Landesgesellschaft kontaktiert werden.
Gebrauchsanweisungen können unter https://eifu.bbraun.com heruntergeladen werden Nach Eingabe der Artikelnummer oder der GTIN werden die zum Produkt gehörenden Dokumente angezeigt.
Die meisten der Bestätigungsschreiben sind online auf bbraun.com unter den jeweiligen Produktdokumenten verfügbar. Wenn sie nicht online zu finden sind, können sie bei der jeweiligen Vertriebsorganisation angefordert werden. Eine Übersicht über die Länderorganisationen finden Sie hier.
Das Bestätigungsschreiben der Benannten Stelle bezieht sich auf die Verordnung (EU) 2023/607 und ist ein Bestätigungsschreiben. In diesem Schreiben bestätigt die Benannte Stelle, dass der Hersteller (einschließlich der betreffenden Produkte) die Anforderungen dieser Verordnung erfüllt. Diese Bestätigungsschreiben können über den Kundendienst angefordert werden.
Die MDR schreibt lediglich vor, dass ein eindeutiger Hinweis auf die Frist für die sichere Anwendung oder Implantation des Produkts gegeben werden muss, zumindest ausgedrückt in Form von Jahr und Monat, sofern dies relevant ist.
Produkte von B. Braun, auf denen das Mindesthaltbarkeitsdatum mit Monat und Jahr angegeben ist, können bis zum Ende des Monats verwendet werden.
Mehr Infos dazu
Hier finden Sie eine Sammlung nützlicher Links zu Informationen auf offiziellen Websites der Europäischen Kommission und anderen Quellen.
-
Datenblatt für medizinisches Fachpersonal (EU-Website)
link
-
EU-Journal: Medizinprodukteverordnung
link
-
Liste der benannten Stellen (EU)
link
-
EUDAMED-Zeitplan (EU)
link
-
B. Braun Elektronische Gebrauchsanweisung (eIFU)
link
-
B. Braun Merkblatt zur MDR
pdf, 53.6 KB
-
Fragen und Antworten zu praktischen Aspekten der MDR-Übergangsbestimmungen
link
Bleiben Sie in Verbindung mit My B. Braun
Mit Ihrem personalisierten Konto wird Ihr Online-Erlebnis einfacher, bequemer und sicherer.